基石药业两款创新产品进入“在审批”,股价走强
蓝鲸财经2021-03-19 17:00
 185,641
185,641该药本次申请的适应症为:用于治疗携带PDGFRA外显子18突变(包括PDGFRA D842V突变)的不可切除性或转移性GIST成人患者。如果获批,它将有望成为中国首个PDGFRA外显子18突变的胃肠道间质瘤治疗药物。
3月19日,中国国家药监局(NMPA)药品注册进度查询结果最新公示,基石药业(2616.HK)申报的KIT和PDGFRA突变激酶抑制剂阿伐替尼 (avapritinib)新药上市申请(NDA)审评审批状态已更新为:在审批。事实上,近期资本市场对于基石这两款新药的获批上市和商业化寄予厚望,自3月9日以来,基石药业股价走势强劲,9个交易日累计涨幅超过20%,其中3月17日基石药业盘中一度上涨超过9%。
公开资料显示,该药本次申请的适应症为:用于治疗携带PDGFRA外显子18突变(包括PDGFRA D842V突变)的不可切除性或转移性GIST成人患者。如果获批,它将有望成为中国首个PDGFRA外显子18突变的胃肠道间质瘤治疗药物。
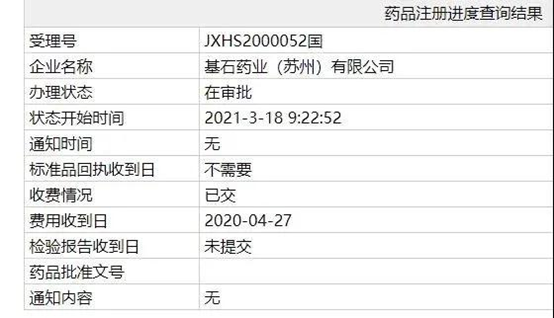
此外,两天前,基石药业申报的另一款精准抗癌药普拉替尼(pralsetinib)新药上市申请也于近日进入“在审批”,并有望成为国内首个获批上市的RET抑制剂。这意味着,基石药业两个重磅精准抗癌产品距离上市更进一步。
据悉,KIT/PDGFRA抑制剂阿伐替尼(Avapritinib)是全球首款靶向PDGFRA 外显子18突变治疗GIST(胃肠道间质瘤)的药物,已获得FDA批准上市。随后,基石药业在国内递交上市申请,并于2020年7月获得NMPA优先审评资格。而普拉替尼即将获批的适应症为既往接受过含铂化疗的RET基因融合阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。
*特别声明:文章内容仅供参考,不构成投资建议。投资者据此操作风险自担。



