 158,654
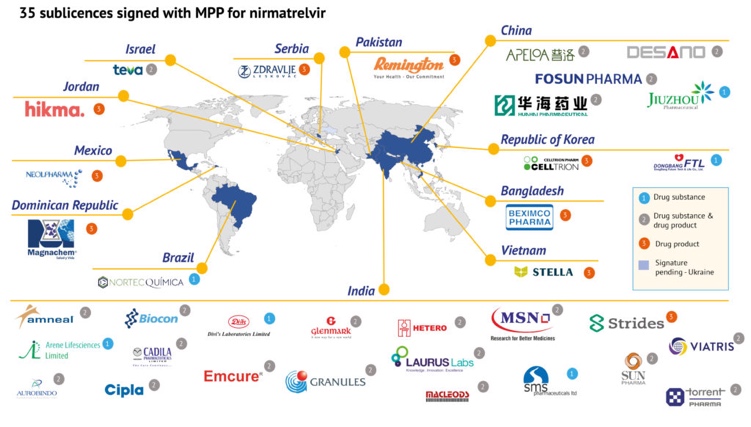
158,654日内瓦当地时间3月17日,药品专利池组织(Medicines Patent Pool,MPP)官网信息显示,已与35家药企签署协议,允许其生产辉瑞新冠口服药Paxlovid成分之一奈玛特韦(nirmatrelvir)原料药和/或制剂,并在95个中低收入国家供应(覆盖全球约53%人口,中国不在授权范围内)。
辉瑞公司的Paxlovid为口服小分子新冠病毒治疗药物,是 PF-07321332 (nirmatrelvir)和利托那韦(Ritonavir)的口服复方制剂,用于治疗成人伴有进展为重症高风险因素的轻至中度新型冠状病毒肺炎患者,根据辉瑞在2021年公布的研究性新型COVID-19口服抗病毒候选药物Paxlovid研究结果,中期分析显示,该药物将高危新冠患者住院和死亡风险降低了89%。
包括上海迪赛诺、华海药业、普洛药业、复星医药、九洲药业在内的五家中国药企进入辉瑞新冠口服药Paxlovid“特仿”名单。其中,九洲药业仅获授权生产原料药,另外包括复星医药在内的4家可同时生产原料药和制剂。
新闻稿显示,在COVID-19仍被世界卫生组织列为国际关注的突发公共卫生事件的情况下,辉瑞将不会对低收入国家销售收取授权使用费,并将进一步免除在协议涵盖的所有国家/地区的销售授权使用费。对于中低收入和中上收入国家或地区的公共部门,辉瑞将收取5%的销售授权使用费,对于私营部门则收取10%的销售授权使用费。
2月8日,辉瑞公布2021年业绩,实现营收813亿美元,同比大涨92%,其口服抗病毒药物在2021年12月22日刚刚获得FDA的EUA批准,已拿下美国政府2000万疗程订单,辉瑞预计年底将实现1.2亿疗程产能,实现超220亿美元的高收入。
中信证券医药研报指出,目前世界多国和地区已批准Paxlovid紧急使用或临时授权,并向辉瑞公司确立Paxlovid订单,但由于产能相对紧张,辉瑞预计2022年Paxlovid供货量约达1.2亿个疗程(其中美国和英国政府已经预定了至少2275万个疗程,同时辉瑞也承诺向低收入国家供应1000万个疗程)。
“考虑到本次MPP授权涵盖95个中低收入国家,预计终端市场需求量将显著增加,我们预计获得MPP授权的国内企业,有望分享上述市场增量。同时根据Airfinity数据,考虑到Paxlovid生产过程需要从全球供应商大量采购38种不同的原料和试剂,我们预计Paxlovid上游中间体产业链有望迎来较大需求量,也建议积极关注。”研报指出。
此前,1月20日,MPP组织宣布与27家仿制药企业签署协议,生产默沙东口服COVID-19抗病毒药物molnupiravir,并向105个低收入和中等收入国家供应,此份协议允许仿制药制造商生产molnupiravir原料药和/或制剂。27家企业中,5家公司将重点生产原料药,13家公司将同时生产原料药和制剂,9家公司将生产制剂,这些公司遍布全球,包括孟加拉国、中国、埃及/约旦、印度、印度尼西亚、肯尼亚、巴基斯坦、南非等11个国家。
其中,5家中国药企获得仿制药资格,分别是复星医药、龙泽制药、博瑞医药、迪赛诺医药以及朗华制药、其中,复星医药、龙泽制药、博瑞医药、迪赛诺医药获许可同时生产Molnupiravir的原料药和成品药,朗华制药则获许生产Molnupiravir的原料药。
根据上述两次授权协议,复星医药、上海迪赛诺两家药企同时拿下默沙东和辉瑞两家企业新冠特效药的仿制生产权。



